MODERNA - Impfstoffaktie fällt! FDA blockt Grippeimpfstoff ab
- Lesezeichen für Artikel anlegen
- Artikel Url in die Zwischenablage kopieren
- Artikel per Mail weiterleiten
- Artikel auf X teilen
- Artikel auf WhatsApp teilen
- Ausdrucken oder als PDF speichern
Erwähnte Instrumente
- VerkaufenKaufen
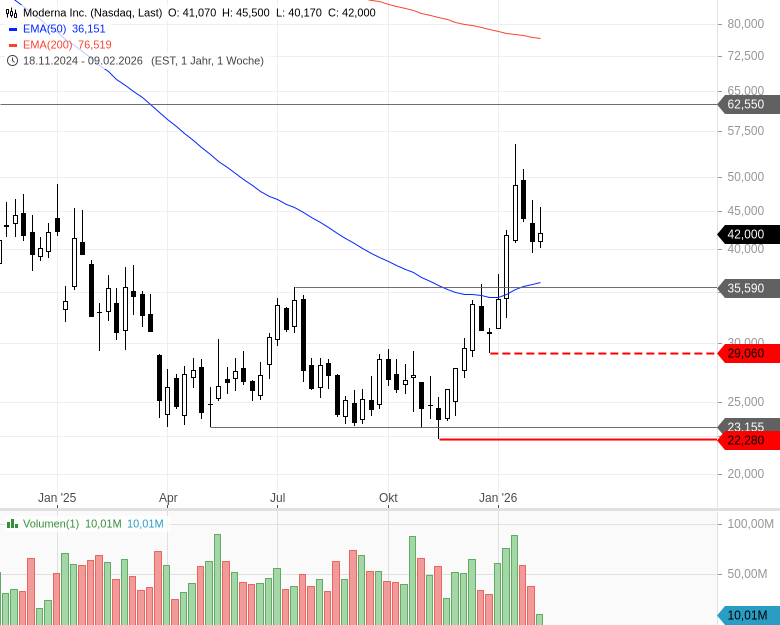
- Moderna Inc. - WKN: A2N9D9 - ISIN: US60770K1079 - Kurs: 42,000 $ (Nasdaq)
Moderna hat von der US-Arzneimittelbehörde FDA ein Refusal-to-file-Schreiben für den Zulassungsantrag des saisonalen Grippeimpfstoffs mRNA-1010 erhalten. Die Behörde startet damit formal gar nicht erst in die inhaltliche Prüfung der Biologics License Application, sondern stellt den Antrag bereits an der Eingangstür zurück.
Kernkritik der FDA beziehungsweise des für Impfstoffe zuständigen Center for Biologics Evaluation and Research ist der Studienaufbau. Aus Sicht der Behörde fehlte in der Phase-III-Zulassungsstudie ein "angemessener und gut kontrollierter" Vergleichsarm, der "den bestverfügbaren Behandlungsstandard widerspiegelt". Moderna hatte mRNA-1010 gegen einen zugelassenen Standarddosis-Grippeimpfstoff getestet.
Wichtig: Die FDA nennt laut Moderna keinerlei konkrete Sicherheits- oder Wirksamkeitsbedenken. Der formale Stopp bezieht sich ausschließlich auf die Wahl des Vergleichsimpfstoffs und damit auf das Studiendesign.
Widerspruch zu früherer FDA-Kommunikation
Brisant ist der offensichtliche Widerspruch zur Vorgeschichte. Nach Unternehmensangaben hatte die FDA im April 2024 schriftlich bestätigt, dass ein zugelassener Standarddosis-Grippeimpfstoff als Comparator in der Phase-III-Studie akzeptabel sei, mit der Empfehlung, nach Möglichkeit einen für über 65-Jährige bevorzugt empfohlenen Impfstoff einzusetzen.
Moderna betont, beide Phase-III-Studien mit insgesamt 43.808 Teilnehmern hätten alle vordefinierten primären Endpunkte erreicht und eine statistische Überlegenheit von mRNA-1010 gegenüber den jeweils eingesetzten Vergleichsimpfstoffen gezeigt.
Nun sieht sich der Konzern mit der Einschätzung konfrontiert, dass diese Comparatoren nicht den Vorstellungen der FDA entsprochen hätten. Aus Unternehmenssicht widerspricht dies den zuvor dokumentierten Rückmeldungen der Behörde. Moderna verweist zudem darauf, dass die relevanten FDA-Guidelines nicht explizit verlangen, stets den jeweils stärksten oder modernsten verfügbaren Impfstoff als Vergleichsprodukt zu wählen.
Moderna hat eine Type-A-Besprechung mit der FDA beantragt, um die Gründe im Detail zu verstehen und einen gangbaren Weg für eine erneute Einreichung auszuloten. Den vollständigen Brief der Behörde hat das Unternehmen auf seiner Website veröffentlicht.
Regulierungsklima und politische Großwetterlage
Die Entscheidung fällt in ein Umfeld verschärfter US-Impfstoffregulierung. Medienberichte stellen den Vorgang in den Kontext eines restriktiveren Kurses unter der aktuellen Administration und Gesundheitsminister Robert F. Kennedy Jr., der als prominenter Impfkritiker gilt.
Im Fokus steht dabei auch Vinay Prasad, der als Leiter des CBER seit seiner Rückkehr zur FDA für eine strengere Auslegung der Vorgaben bei Impfstoffen steht. Er unterzeichnete das Refusal-to-file-Schreiben vom 3. Februar und hatte sich zuvor öffentlich für schärfere Kriterien bei Vakzinen ausgesprochen.
Diese Gemengelage kann aus Investorensicht ein Hinweis darauf sein, dass innovative Impfprojekte in den USA in den kommenden Jahren mit längeren und regulatorisch anspruchsvolleren Pfaden rechnen müssen, selbst wenn Sicherheits- und Wirksamkeitsdaten positiv ausfallen.
Auswirkungen auf Timeline und Guidance
Operativ verschiebt sich für Moderna in den USA der frühestmögliche Zulassungszeitpunkt. Die ursprüngliche Idee eines zügigen Reviews mithilfe eines Priority Review Voucher ist vorerst gescheitert. Aus jetziger Sicht rechnet das Unternehmen mit ersten möglichen Zulassungen für mRNA-1010 frühestens Ende 2026 oder Anfang 2027, abhängig von den laufenden Prüfungen.
Wichtig: Die FDA hat nur den Start der Prüfung in den USA verweigert, in anderen Märkten laufen die Prozesse weiter. In der Europäischen Union, Kanada und Australien wurden die Anträge angenommen und befinden sich im regulären Review.
Finanziell dämpft Moderna die kurzfristige Sorge. Der Konzern erwartet nach eigenen Angaben keine Auswirkungen auf die Finanz-Guidance für 2026. Das unterstreicht zum einen die zeitliche Distanz der erwarteten Umsatzbeiträge, zum anderen die Pipelinebreite rund um kombinierte Impfstoffe wie Influenza plus Covid-19, für die mRNA-1010 als Baustein gedacht ist.
An der Börse kam die Nachricht dennoch nicht gut an. Die Moderna-Aktie gab im nachbörslichen US-Handel um rund 9 % nach.
Fazit: Sollte die Moderna-Aktie wieder in den Kursbereich um 35/36 USD zurückfallen, wird sie aus Tradersicht interessant im Sinne eines Pullbackszenarios. Anleger können sich auf stock3 Terminal Kursalarme setzen.
Jetzt mit dem comdirect Depot über stock3 handeln
Profitiere von unserem aktuellen Angebot 2 Jahre nur 3,90 Euro je Trade zu zahlen und sichere dir zusätzlich 100 Euro Prämie. Starte den Handel mit stock3!
✔️ Aktion bis 31.05.2026: 100 Euro Prämie
✔️ Zusätzlich: 2 Jahre ab 3,90 Euro pro Trade handeln
✔️ Kostenlose Depotführung ohne Bedingungen
✔️ ETF- und Fonds-Specials zu günstigen Konditionen
✔️ Handel direkt über stock3
Passende Produkte
| WKN | Long/Short | KO | Hebel | Laufzeit | Bid | Ask |
|---|



Keine Kommentare
Die Kommentarfunktion auf stock3 ist Nutzerinnen und Nutzern mit einem unserer Abonnements vorbehalten.